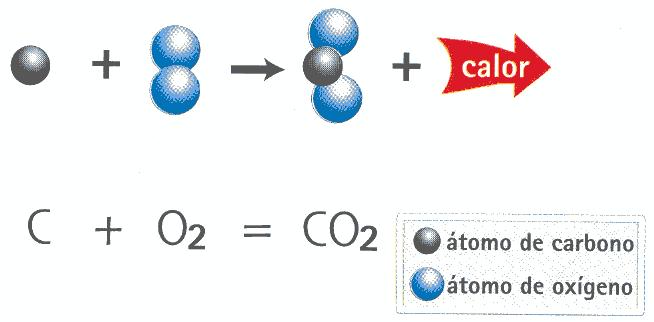
El dióxido de carbono se encuentra principalmente en el aire, pero también en el agua formando parte del ciclo del carbono. Le podemos mostrar cómo funciona el ciclo del carbono, por medio de una explicación y una representación esquemática.
Aplicaciones del dióxido de carbono por los humanos
Los seres humanos usamos el dióxido de carbono de muchas formas diferentes. El ejemplo más familiar es el uso en bebidas refrescantes y cerveza, para hacerlas gaseosas. El dióxido de carbono liberado por la levadura hace que la masa se hinche.
Algunos extintores usan dióxido de carbono porque es más denso que el aire. El dióxido de carbono puede cubrir un fuego, debido a su pesadez. Impide que el oxígeno tenga acceso al fuego y como resultado, el material en combustión es privado del oxígeno que necesita para continuar ardiendo.
El dióxido de carbono también es usado en una tecnología llamada extracción de fluído supercrítico que es usada para descafeinar el café. La forma sólida del dióxido de carbono, comúnmente conocida como hielo seco, se usa en los teatros para crear nieblas en el escenario y hacer que cosas como las “pociones mágicas” burbujeen.
El papel del dióxido de carbono en los procesos ambientales
El dióxido de carbono es uno de los gases más abundantes en la atmósfera. El dióxido de carbono juega un papel importante en los procesos vitales de plantas y animales, tales como fotosíntesis y respiración. A continuación explicaremos brevemente estos procesos.
Las plantas verdes transforman el dióxido de carbono y el agua en compuestos alimentarios, tales como glucosa y oxígeno. Este proceso se denomina fotosíntesis.
La reacción de la fotosíntesis es como sigue:
6 CO2 + 6 H2O --> C6H12O6 + 6 O2
Las plantas y los animales, a su vez, transforman los componentes alimentarios combinándolos con oxígeno para obtener energía para el crecimiento y otras funciones vitales. Este es el proceso de respiración, el inverso de la fotosíntesis.
La reacción de la respiración es como sigue::
C6H12O6 + 6 O2 --> 6 CO2 + 6 H2O
La fotosíntesis y la respiración juegan un papel muy importante en el ciclo del carbón y están en equilibrio entre sí.
La fotosíntesis domina durante la época más templada del año y la respiración domina durante la época más fría del año. Sin embargo, ambos procesos tienen lugar a lo largo de todo el año. En conjunto, entonces, el dióxido de carbono en la atmósfera disminuye durante la época de crecimientoy aumenta durante el resto del año.
Debido a que las estaciones en los hemisferios norte y sur son opuestas, el dióxido de carbono en la atmósfera aumenta en el norte mientras que disminuye en el sur, y viceversa. El ciclo está más claramente presente en el hemisferio norte; porque tiene relativamente más masa y vegetación terrestre. Los océanos predominan en el hemisferio sur.
Influencia del dióxido de carbono en la alcalinidad
El dióxido de carbono puede cambiar el pH del agua. Así es como funciona:
El dióxido de carbono se disuelve ligeramente en agua para formar un ácido débil llamado ácido carbónico, H2CO3, de acuerdo con la siguiente reacción:
CO2 + H2O --> H2CO3
Después de esto, el ácido carbónico reaciiona ligera y reversiblemente en el agua para formar un catión hidronio, H3O+, y el ión bicarbonato, HCO3-, de acuerdo con la siguiente reacción:
H2CO3 + H2O --> HCO3- + H3O+
Este comportamiento químico explica por qué el agua, que normalmente tiene un pH neutro de 7, tiene un pH ácido de aproximadamente 5.5 cuando ha sido expuesta al aire.
Emisiones de dióxido de carbono por el hombre
Debido a las actividades humanas, la cantidad de CO2 liberada a la atmósfera ha estado aumentando enormemente durante los últimos 150 años. Como resultado, ha excedido la cantidad absorbida por la biomasa, los océanos y otros sumideros.
Ha habido un aumento de la concentración de dióxido de carbono en la atmósfera de alrededor de 280 ppm en 1850 a 364 ppm en 1998, principalmente debido a las actividades humanas durante y después de la revolución industrial, que empezó en 1850.
Los humanos han estado incrementando la cantidad de dióxido de carbono en el aire quemando combustibles fósiles, produciendo cemento y clareando terreno y quemando bosques. Alrededor del 22% de la actual concentración de CO2 en la atmósfera existe debido a estas actividades humanas, considerando que no hay cambio en las cantidades naturales de dióxido de carbono. En el siguiente párrafo hablaremos de estos efectos con más detalle.
 |
| Añadir leyenda |